Le transport des molécules dans les prolongements des neurones, appelés axones, est un processus capital pour la survie de ces cellules et le bon fonctionnement du système nerveux. Celui-ci est assuré par des vésicules qui se déplacent rapidement grâce à des moteurs moléculaires qui ont besoin d’énergie. Au laboratoire « Signalisation, neurobiologie et cancer » (Institut Curie/CNRS/Inserm) situé à l’Institut Curie, l’équipe de Frédéric Saudou[1], directeur de recherche Inserm, montre que ces vésicules ont leur propre système de production d’énergie nécessaire à leur transport et ne dépendent pas des mitochondries, qui sont la source principale d’énergie pour les cellules. Ce mécanisme met en jeu la glycolyse, qui est la première étape de la transformation du glucose ainsi que la protéine huntingtine, mutée dans la maladie de Huntington, une pathologie neurodégénérative. Ces résultats sont publiés le 31 janvier 2013 dans la revue Cell.
À l’inverse des cancers où les cellules prolifèrent, les maladies neurodégénératives telles que les maladies d’Alzheimer, de Parkinson ou de Huntington sont dues à la mort accélérée de neurones. Au laboratoire « Signalisation, neurobiologie et cancer » (Institut Curie/CNRS/Inserm) situé à l’Institut Curie, l’équipe de chercheurs dirigée par Frédéric Saudou étudie la fonction de la protéine huntingtine, mutée dans la maladie de Huntington. « Quand elle est altérée, la huntingtine entraîne, par un mécanisme encore mal connu, la mort accélérée des neurones du striatum, région du cerveau où débute la maladie de Huntington » explique Frédéric Saudou.
Son équipe a notamment démontré le rôle essentiel de la huntingtine dans le transport rapide de vésicules le long des prolongements neuronaux ou axones. Ainsi, la huntingtine stimule le transport des vésicules en interagissant avec les moteurs moléculaires, permettant leur acheminement dans des régions précises du cerveau comme le striatum, structure cérébrale atteinte dans la pathologie de Huntington.
L’ATP, moteur essentiel au transport des vésicules
D’où provient l’énergie cellulaire nécessaire pour assurer le transport de ces vésicules dans les axones sur des longues distances, qui peuvent dans certains cas atteindre un mètre ? La molécule d’adénosine triphosphate (ATP) est la source d’énergie commune aux espèces animales et végétales. Chez l’homme, celle-ci est produite majoritairement par des organites spécialisés de la cellule, les mitochondries. «Dans ce travail, nous montrons qu’un processus autre que les mitochondries est impliqué dans la fourniture d’énergie aux moteurs moléculaires[2] responsables du transport dans les axones» explique Frédéric Saudou. En effet, l’inhibition de la fonction des mitochondries n’a pas d’incidence sur ce transport rapide. En revanche, l’inactivation génétique d’une enzyme essentielle à la glycolyse, première étape de la transformation du glucose en énergie réduit, elle, significativement ce transport.
Un mécanisme dépendant de la protéine huntingtine
« Des enzymes permettant la glycolyse sont localisées directement sur les vésicules et produisent l’énergie nécessaire à leur déplacement dans les axones. Nous nous sommes alors interrogés sur le mécanisme qui assure sa fixation à la membrane des vésicules. Nos recherches établissent que l’attachement aux vésicules est assuré par la protéine huntingtine. En revanche nous ne savons pas encore si cette fonction est perturbée dans la maladie de Huntington » souligne Frédéric Saudou. Néanmoins les chercheurs n’excluent pas l’existence d’autres mécanismes pour lier ces enzymes de la glycolyse à la membrane de la vésicule.
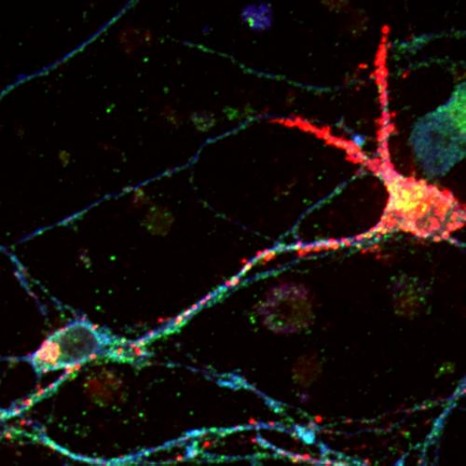
Image prise en microscopie révélant la localisation au niveau des vésicules d’une enzyme de la glycolyse, la protéine GAPDH (en rouge), avec la huntingtine (en vert) dans un neurone issu de cortex de rat. Les vésicules sont marquées spécifiquement en bleu.
©Diana Zala/Institut Curie
Affection neurologique rare, la maladie de Huntington touche 1 personne sur 10 000 et se manifeste à l’âge adulte. Les symptômes les plus caractéristiques sont des troubles mentaux (anxiété, irritabilité, dépression), une détérioration intellectuelle qui progresse jusqu’à la démence, auxquels sont associés des mouvements anormaux involontaires et saccadés des membres, de la tête et du cou.
L’anomalie génétique qui provoque la maladie de Huntington est une augmentation anormale de la répétition de trois acides nucléiques (C, A et G – appelé triplet CAG) dans le gène codant pour la protéine huntingtine. Il en résulte une expansion anormale d’une répétition d’un acide aminé (répétition polyglutamine ou polyQ) dans la protéine huntingtine. Les mécanismes qui conduisent à la pathologie sont encore mal connus et il n’existe pour l’instant aucun traitement pour prévenir l’apparition des symptômes chez les patients. La meilleure compréhension des processus cellulaires survenant au niveau des neurones devrait permettre l’identification de nouvelles stratégies thérapeutiques pour cette maladie neurodégénérative. La compréhension de ces mécanismes pourrait également avoir un intérêt pour d’autres pathologies comme les cancers.
[1] Frédéric Saudou est chef de l’équipe « Signalisation cellulaire et neurobiologie» dans l’unité Signalisation, neurobiologie et cancer Institut Curie/CNRS UMR 3306/Inserm U1005