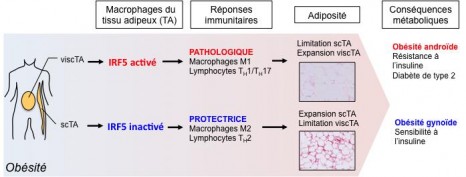
Irf5 deficiency in macrophages promotes beneficial adipose tissue expansion and insulin sensitivity during obesity Elise Dalmas1,2,13, Amine Toubal1–3,13, Fawaz Alzaid2,3,13, Katrina Blazek4, Hayley L Eames4, Kristell Lebozec2,3, Maria Pini1,2, Isabelle Hainault2,3, Emilie Montastier5–7, Raphaël G P Denis8, Patricia Ancel1,2, Amélie Lacombe2, Yin Ling1,2, Omran Allatif1,2, Céline Cruciani-Guglielmacci8, Sébastien André1,2, Nathalie Viguerie6,7, Christine Poitou1,2,9, Vladimir Stich10,11, Alexandra Torcivia12, Fabienne Foufelle2,3, Serge Luquet8, Judith Aron-Wisnewsky1,2,9, Dominique Langin9,10, Karine Clément1,2,9, Irina A Udalova4 & Nicolas Venteclef 2,3
1 Sorbonne Universités, Université Pierre et Marie-Curie; INSERM UMR_S 1166-ICAN, Nutriomics, Paris, France.
2 Institute of Cardiometabolism and Nutrition, Paris, France.
3 Sorbonne Universités, Université Pierre et Marie-Curie, INSERM, UMR_S 1138 Cordeliers Research, Paris, France.
4 Kennedy Institute Trust of Rheumatology, University of Oxford, Oxford, UK.
5 INSERM, University of Toulouse, Paul Sabatier University, UMR 1048, Toulouse, France.
6 Department of Clinical Biochemistry, Toulouse University Hospitals, Toulouse, France.
7 Department of Nutrition, Toulouse University Hospitals, Toulouse, France.
8 Université Paris Diderot, Sorbonne Paris Cité, Unité de Biologie Fonctionnelle et Adaptative, CNRS UMR 8251, Paris, France.
9 Heart and Metabolism Division, Pitié-Salpêtrière Hospital, Assistance Publique-Hôpitaux de Paris, Paris, France.
10 Department of Sports Medicine, Third Faculty of Medicine, Charles University in Prague, Prague, Czech Republic.
11 Franco-Czech Laboratory for Clinical Research on Obesity, Third Faculty of Medicine, Charles University in Prague, Prague, Czech Republic.
12 Visceral Surgery Division, Pitié-Salpêtrière Hospital, Assistance Publique-Hôpitaux de Paris, Paris, France.
13 These authors contributed equally to this work.
Nature Medicine, 4 mai 2015