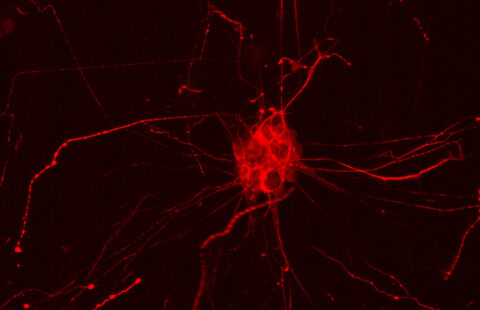
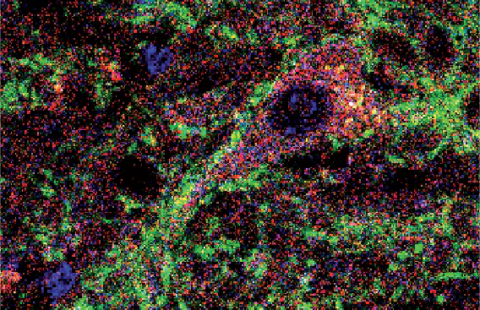
La maladie de Huntington se caractérise par l’atrophie d’une zone spécifique du cerveau : le striatum. Cette atrophie pourrait être liée au mauvais fonctionnement de la dynéine, une protéine essentielle au transport des molécules dans les neurones. C’est ce que concluent des recherches menées par une équipe internationale de 23 chercheurs coordonnés par Luc Dupuis de l’unité Inserm 692 de Strasbourg et Albert Ludolph de l’Université d’Ulm (Allemagne). Leurs résultats sont publiés en ligne dans la revue Human Molecular Genetics.
La maladie de Huntington est une maladie neurodégénérative héréditaire qui touche 6000 personnes en France. Elle est due à la mutation d’un gène codant pour la synthèse d’une protéine : la huntingtine. Au niveau anatomique, elle se manifeste par des lésions dans un centre d’intégration du cerveau : le striatum. Apparaissant autour de 45 ans, les malades voient progressivement le déclin de leurs aptitudes physiques et mentales jusqu’à la démence et la mort. Aucun traitement n’existe en effet à ce jour.
Troubles moteurs et comportementaux chez des souris mutées
Depuis 2003, des chercheurs de l’Inserm à Strasbourg travaillent sur une lignée de souris mutées présentant des problèmes musculaires mais aussi des troubles comportementaux tels qu’une hyperactivité. Grâce à des IRM et des observations cellulaires, ils ont mis en évidence des lésions dans le striatum de ces souris mutées. »Nos souris n’ont cependant pas la maladie de Huntington, car elles n’ont pas de mutation sur la huntingtine et vivent tout à fait normalement » précise Luc Dupuis.
Rôle clé de la dynéine dans le fonctionnement des neurones du striatum
Ces souris portent une mutation sur gène codant pour un »moteur » moléculaire : la dynéine. Elle est la seule protéine permettant le transport des cargos (vésicules, protéines, organites) de l’extrémité des axones et des dendrites vers le corps cellulaire. »On soupçonnait la dynéine d’intervenir dans la dégénérescence des cellules striatales, mais, grâce à ce travail, nous avons apporté la preuve directe de ce lien » explique Luc Dupuis.
La maladie de Huntington pourrait ainsi être liée à un mauvais fonctionnement de la dynéine. C’est une hypothèse importante lorsque l’on sait que la dynéine ne se déplace à »pleine vitesse » que si elle est associée à d’autres protéines, notamment à la huntingtine. »La dynéine transporte de multiples cargos. Notre travail consiste maintenant à déterminer quel(s) cargo(s) transportés sont essentiels au fonctionnement du striatum. Mais d’autres pistes pour mieux comprendre la maladie de Huntington ne sont pas à négliger » souligne Luc Dupuis.06